Botanik online 1996-2004. Die Seiten werden nicht mehr bearbeitet, sie bleiben als historisches Dokument der botanischen Wissenschaft online erhalten!
Photomorphogenese, Phytochrom
Seit Beginn der experimentellen Pflanzenphysiologie befaßte man
sich mit dem Einfluß von Licht auf die Entwicklung der Pflanzen.
Hervorzuheben sind die von J. v. SACHS entwickelten
Versuchseinrichtungen und die späteren Arbeiten von W.
PFEFFER und J. BONNER.
Im Dunkeln kultivierte Keimlinge zeichnen sich in der Regel durch intensives
Streckungswachstum aus. Die Internodien rücken unverhältnismäßig
weit auseinander, Blattanlagen werden gebildet, doch eine Ausdifferenzierung
zu Blattspreiten unterbleibt. Die Sprosse sind gelblich, da fast kein Chlorophyll
entsteht. Vorsicht Ausnahmen: Tradescantia albiflora, dann einige Gymnospermen, und viele niedere Pflanzen
bilden auch bei Dunkelheit Chlorophyll. Die durch Lichtmangel gestörte
Entwicklung wird Etiolement genannt, die Pflanzen sind etioliert.
Ein Überangebot an Licht, z.B. eine starke UV-Strahlung im Hochgebirge,
führt zu drastisch reduziertem Streckungswachstum der Internodien,
zu einer Verkleinerung der assimilierenden Oberfläche, vielfach zu
starker Anthocyanbildung und meist zu intensiver gefärbten Blüten.
Die hier skizzierten, bereits im vorigen Jahrhundert bekannten Befunde
wurden in den letzten Jahrzehnten durch Aussagen aus gezielten Experimenten
ergänzt und gestützt. Hierbei ging es zunächst einmal um
die Frage, welche der Differenzierungs- und Wachstumsleistungen lichtabhängig
sind, wie das Wirkungsspektrum aussieht und welche Lichtmengen benötigt
werden.
H. MOHR und Mitarbeiter (Institut für Biologie, Universität
Freiburg) haben durch Untersuchungen an Sinapis alba-Keimlingen
eine Vielzahl lichtinduzierter Reaktionen analysiert. Im Gegensatz zu vielen
niederen (vorwiegend aquatischen) Pflanzen, bei denen lichtinduzierte Reaktionen
meist, aber nicht ausschließlich, durch kurzwellige Strahlung (Blaulicht)
ausgelöst werden, ist bei der Photomorphogenese der höheren Landpflanzen
in der Regel eine langwelligere Strahlung ausschlaggebend. Hierauf aufbauend,
entwickelten H. A. BORTHWICK, S. B. HENDRICKS und Mitarbeiter (Plant Industry
Station, US Department of Agriculture, Beltsville, Md.) im Zeitabschnitt
zwischen 1946 und 1959 das Konzept des Hellrot/Dunkelrot-, bzw. Phytochromsystems.
|
Einige durch Licht bewirkte Reaktionen des Senfkeimlings (Sinapis
alba).
Alle diese Photomorphosen können auf die Bildung von PFR
zurückgeführt werden
(aus H. MOHR und P. SCHOPFER, 1978)
|
Hemmung des Hypokotyl-Längenwachstums
Hemmung der Translokation aus den Kotyledonen
Flächenwachstum der Kotyledonen
Entfaltung der Lamina der Kotyledonen
Haarbildung am Hypokotyl
Öffnung des Hypokotyl-Hakens
Entwicklung der Primärblätter
Bildung von Folgeblatt-Primordien
Steigerung der negativ geotropen Reaktionsfähigkeit des Hypokotyls
Bildung von Xylemelementen
Differenzierung der Stomata in der Epidermis der Kotyledonen
Bildung von Superetioplasten im Mesophyll der Kotyledonen
Änderungen der Intensität der Zellatmung
Synthese von Anthocyan in Kotyledonen und Hypokotyl
Steigerung der Carotinoidsynthese
Steigerung der Kapazität der Chlorophyllsynthese
Steigerung der RNS-Synthese in den Kotyledonen
Steigerung der Proteinsynthese in den Kotyledonen
Intensivierung des Abbaus der Speicherfette
Intensivierung des Abbaus der Speicherproteine
Steigerung der Äthylensynthese
Beschleunigung des Shibata-shifts in den Kotyledonen
Determination der Kapazität der Photophosphorylierung in den Kotyledonen
Modulation der Enzymsynthese in den Kotyledonen
|
 Das
Phytochrom ist ein Chromoprotein, dessen Zustand durch Licht beeinflußt
wird. Es wird vorwiegend bei Dunkelheit gebildet und liegt zunächst
als PR vor (P ist die Abkürzung für Phytochrom, R
steht für red). Nach Bestrahlung mit lambda= 660 nm Licht (hellrot,
red) geht es in PFR über [FR=far red; auf deutsch
könnte man auch schreiben: PHR (hellrot), resp. PDR
(dunkelrot); oder unter Verwendung der Wellenlängen P660,
resp P730]. PFR wird durch lambda = 730 nm
Licht (dunkelrot) in PR rücküberführt. PR
ist die biologisch inaktive, PFR die biologisch aktive Form.
Das
Phytochrom ist ein Chromoprotein, dessen Zustand durch Licht beeinflußt
wird. Es wird vorwiegend bei Dunkelheit gebildet und liegt zunächst
als PR vor (P ist die Abkürzung für Phytochrom, R
steht für red). Nach Bestrahlung mit lambda= 660 nm Licht (hellrot,
red) geht es in PFR über [FR=far red; auf deutsch
könnte man auch schreiben: PHR (hellrot), resp. PDR
(dunkelrot); oder unter Verwendung der Wellenlängen P660,
resp P730]. PFR wird durch lambda = 730 nm
Licht (dunkelrot) in PR rücküberführt. PR
ist die biologisch inaktive, PFR die biologisch aktive Form.

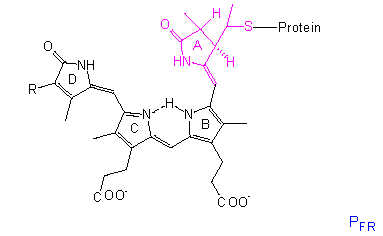

Die chromophore Gruppe ist ein lineares Tetrapyrrol, dessen Konformation
und Absorptionsspektrum sich in der PR-Form
deutlich von der in PFR unterscheidet. Eine ähnliche Gruppe
mit vergleichbaren Konformationsänderungen liegt in den Bilirubinen der
Rotalgen vor, dort steht lediglich anstelle der Vinylgruppe am Ring D eine
Äthylgruppe.
Das Protein ist ein Dimer, es besteht aus gleichen Untereinheiten, deren
Molekulargewichte je nach Pflanzenart zwischen 120000 und 127000 liegen;
folglich ist es ein allosterisches Protein. Nach allem, was wir aus der
Proteinstrukturforschung wissen, wirkt eine Strukturänderung im Chromophor
wie ein Hebel und zieht eine Konformationsänderung des Proteins nach
sich; der allosterische Effekt bedingt eine weitere Amplifikation (Signalverstärkung).
Dadurch ändern sich natürlich auch die Bindungseigenschaften
des Phytochroms zu anderen Molekülen, so daß eine Kaskade in
Gang kommen kann, an deren Ende die meßbaren physiologischen Phänomene
stehen. Ob das Phytochrom direkt als Effektor fungiert oder ob weitere
Moleküle zwischengeschaltet sind, bleibt zu klären. Vielleicht
ist das auch von Fall zu Fall verschieden.
Für eine Reihe von Genprodukten ließ sich zeigen, daß
das Phytochrom auf Transkriptionsebene (mRNS) kontrollierend in das Geschehen
eingreift. Das gilt u.a. für die kerncodierte kleine Untereinheit
der Ribulose-1,5-Bisphosphatcarboxylase und das Chlorophyll - a / b-bindende
Protein. Darüber hinaus wurde gezeigt, daß es in Form einer
Rückkopplungsschleife die Expression seines eigenen Gens reguliert.
PR wird bei Dunkelheit im Cytoplasma gebildet und dort so
lange akkumuliert, bis ein bestimmter Spiegel erreicht ist. Es stellt sich
ein Gleichgewicht zwischen Synthese und (langsamem) Abbau ein. Die Überführung
in PFR nach Bestrahlung mit hellrotem Licht ist ein rasch ablaufender
Prozeß. PFR ist außerordentlich instabil, der Phytochromspiegel
in der Zelle sinkt daher nach Belichtung auf ein bis drei Prozent des ursprünglichen
Werts, der vermutlich ein neues Gleichgewicht zwischen PR-Synthese
und PFR-Abbau repräsentiert. Nach Verdunklung steigt die
Phytochrommenge erneut aufgrund einer de novo-Synthese von PR.
Die PFR-Eliminierung beruht also nicht allein auf einer Proteininaktivierung,
sondern auf einer zusätzlichen Inaktivierung translatierbarer mRNS.
Die negative Rückkopplung wird nach Verdunklung aufgehoben, da der
PFR-Spiegel auf nahezu Null absinkt; gleichzeitig steigt die
mRNS-Menge wieder an (P. H. QUAIL und Mitarbeiter, University of Wisconsin,
Madison).

Gleichgewichtslage
und Regulationsvermögen des Phytochromsystems (Nach P. H. QUAIL, 1984)
Weitere Einzelheiten über den Wirkungsmechanismus erhielt man durch
den Einsatz gentechnischer Verfahren (die mRNS wurde in cDNS überschrieben
und kloniert, Nukleotidsequenzen phytochrom-codierender Gene sind bekannt)
sowie monoklonaler Antikörper gegen bestimmte Domänen des Proteins.
Selbst Arabidopsis thaliana, eine Pflanze mit einem der kleinsten
Genome enthält 5 Phytochromgene, die Nukleotidsequenzen der einzelnen
Gene variieren beträchtlich. Diese und Daten, die an anderen Arten
ermittelt wurden, weisen darauf hin, daß Phytochrome einer sehr variablen
Proteinfamilie mit mindestens 3 Unterfamilien (phyA, phyB, phyC) angehören,
die bereits vor der Abgliederung der Monokotyledonen von ihren Dikotyledonenvorfahren
entstanden sind. Aufrund der proteinanalytischen Daten lassen sich zwei
generell unterschiedliche Photorezeptortypen ausmachen: Typ I oder Phytochrom
etiolierter Gewebe und Typ II, das Phytochrom grüner Gewebe. In etiolierten
Geweben kommt Typ I in großen Mengen vor, unterliegt aber einem hohen
Turnover, Typ II findet sich dort in kleinen Mengen im stabilen Zustand
PFR. Da das Phytochrom Typ I von phyA Genen codiert wird, bezeichnet
man es nun auch als Phytochrom A, das Typ II - Phytochrom hingegen ist
recht heterogen, es besteht aus mindestens 2 immunologisch nicht verwandten
Polypeptidketten (die auch mit dem Phytochrom A keine immunologische Verwandtschaft
aufweisen). Die Polypeptidketten der Phytochrome haben Längen von
1110-1172 Aminosäureresten und gehören damit zu den längsten
Polypeptiden überhaupt; jede Polypeptidkette trägt einen Chromophor
und faltet sich zu zwei Domänen. Es sieht nunmehr so aus, als könnte
die Heterogenität der Phytochrome einerseits, bedingt durch gleichartige
chromophore Gruppe, auf das gleiche Lichtsignal reagieren, aufgrund der
unterschiedlichen Proteinstrukturen das Signal dann aber an unterschiedliche
Rezeptoren weiterleiten und somit eine Anzahl physiologisch unterschiedlicher
Reaktionen induzieren (QUAIL, 1991).
Nachdem gezeigt war, daß das Phytochrom in die Transkriptionskontrolle
eingreift, stellte sich die Frage, ob es auf DNS-Ebene spezifische Erkennungsregionen
gibt, die eine lichtabhängige Transkription des entsprechenden DNS-Abschnitts
bewirken. G. MORELLI et al. (Rockefeller University, New York, 1985)
zeigten - wiederum unter Einsatz gentechnischer Verfahren -, daß
ein 33 Basenpaare langes Stück, welches die TATA-Box (Teil des Promoters)
einschließt und das dem Gen für die kleine
Untereinheit der Ribulose-1,5-Bisphosphatcarboxylase vorgeschaltet
ist, für die lichtinduzierte Steuerung der Genexpression essentiell
ist. Inzwischen wurde die Lichtabhängigkeit der Transkription für
eine ganze Anzahl von Proteinen nachgewiesen, dazu gehören das Chlorophyll
a/b bindende Protein, die a - Untereinheit der ATP Synthetase, das 32-kDa
Protein des Photosystem II, die Chalcon-Synthetase u.a. (SIMPSON und HERRERA-ESTRELLA,
1990), auf der DNS wurden je nach Gen sowohl upstream, als auch downstream
(also am Anfang einer Transkriptionseinheit und an ihrem Ende) Nukleotidsequenzen
ermittelt, die für die lichtinduzierte Steuerung benötigt werden
und die damit für die Modulation der mRNS-Synthese, d.h. für
die Menge der gebildeten mRNS-Sequenzen (Transkripte) verantwortlich sind
(GILMARTIN et al., 1990).
Lokalisation des Phytochroms in Zellen
Durch indirekte Immunfluoreszenz ließ
sich Phytochrom im Plasma der Zellen, im Zellkern und den Plastiden lokalisieren.
Es ist nicht in allen Zellen in gleicher Menge enthalten. Man findet man
es z.B. in der Epidermis ausschließlich in den Schließzellen.
Das Phytochrom ist an der Induktion der Chloroplastendrehung der fädigen
Grünalge Mougeotia beteiligt. Man unterscheidet zwischen der
Schwachlicht- und der Starklichtstellung des plattenförmigen Chloroplasten
(Flächenstellung, Kantenstellung). Wir
haben es hier also mit einer intrazellulären Bewegung zu tun, denn
die Lichtperzeption erfolgt in jeder Zelle getrennt. Es gibt demnach zumindest
auf dieser Ebene auch keinen Informationsaustausch zwischen benachbarten
Zellen. Selbst innerhalb einer Zelle ist die Bewegung der einzelnen Chloroplastenabschnitte
autonom. Nachweisbar ist der Effekt durch eine partielle Bestrahlung einer
Zelle.
W. HAUPT (Botanisches Institut der Universität Erlangen, 1970)
benutzte Mikrostrahlen polarisierten Lichts, mit denen eine Zelle Punkt
für Punkt abgetastet werden konnte. Dadurch ließ sich beweisen,
daß das den Lichtreiz perzipierende Phytochrom hier an der Peripherie
der Zelle (aller Voraussicht nach im Plasmalemma) liegt und in einer bestimmten
Weise orientiert ist.
Der Chloroplast reagiert auf eine Bildung (Anreicherung) von PFR
. Bei dessen Bildung aus PR drehen sich die Photorezeptoren
um 90 Grad. PR ist parallel zur Zelloberfläche orientiert,
PFR senkrecht dazu. Der Chloroplast
dreht sich daher stets von Orten höchster PFR-Konzentration
weg.
Bliebe zu fragen, wodurch die Drehung selbst bewirkt wird. Es sieht
so aus, als sei das Aktin daran beteiligt; doch wie das Lichtsignal in
Bewegungsenergie umgesetzt wird und wie die Aktinfilamente an Chloroplasten
ansetzen, bleibt nach wie vor offen.
Eine orientierte Ausrichtung von Phytochrommolekülen an der Zellperipherie
ist nicht auf Mougeotia beschränkt. Eine ähnliche Erscheinung
liegt der phototropen Reaktion von Farnchloronemen zugrunde. Andererseits
ist Phytochrom - vor allem bei Algen - nicht das dominierende Sensorpigment.
Blaulicht hat einen stärkeren Einfluß; mit steigender Wassertiefe
nimmt der Anteil kurzwelligen Lichts bekanntlich zu. Das auf langwelliges
Licht adaptierte Phytochromsystem hätte keinerlei Vorteile.
Für die Lichtperzeption bei der Chloroplastenbewegung verschiedener
Algen und anderer Organismen, sind vier physikalisch unterschiedliche
Konzepte erkannt worden.
Hochintensitätsreaktionen (HIR), Signalamplifikation; Cryptochrom
Es gibt eine Reihe physiologischer Prozesse, beispielsweise die Anthocyanbildung,
die erst bei länger andauernder Bestrahlung aktiviert oder auf maximale
Leistung gebracht werden. Das Wirkungsspektrum umfaßt einen weiten
Lichtwellenbereich; mehr als man aufgrund der Absorptionsspektren des Phytochroms
erwarten dürfte. Offensichtlich wird demnach mehr als nur ein Sensorpigment
aktiviert.
K. M. HARTMANN (seinerzeit Institut für Biologie, Universität
Freiburg) zeigte bereits 1966, daß das Wachstum von Salatkeimlingen
durch getrennt gegebenes Licht der Wellenlängen lambda = 658
nm und lambda = 768 nm unwirksam ist, während eine simultane
Bestrahlung mit Licht dieser beiden Wellenlängen zu einer Wachstumszunahme
führt. Alles weist darauf hin, daß auch diese Reaktionen allein
über Phytochrom laufen. Man benötigt nur die Zusatzannahme, daß
es außer PR und PFR weitere Formen: PRX,
PFRX, PRX' und PFRX' gibt, die reversibel
(direkt oder indirekt) ineinander übergehen und in der Zelle in einem
Gleichgewicht zueinander stehen. Es sieht also so aus, als gäbe es
einen Energietransfer zwischen den Sensorpigmenten (oder deren unterschiedlichen
Aktivitätszuständen), wodurch die Empfindlichkeit gegenüber
Licht stark moduliert werden kann. Das Signal erfährt dadurch eine
Verstärkung (Amplifikation). Das Wirkungsspektrum der Anthocyanbiosynthese
weist auf die Existenz weiterer Pigmente hin. Viel spricht für zusätzliche
Photorezeptoren für den Blau- und UV-Anteil des Spektrums. Solche
sind in der Tat nachgewiesen worden (Cryptochrom [Blaulichtrezeptor] und
der UV-B-Photorezeptor), und es konnte gezeigt werden, daß beide
modulierend auf das Phytochromsystem einwirken. Für die Pflanze wäre
es von Vorteil, weil sie damit exakt und unmittelbar auf die an natürlichen
Standorten herrschenden Lichtbedingungen reagieren könnte. Bei Algen
stimuliert Blaulicht die Carotinoidsynthese, die Chlorophyllsynthese und
den Glucoseabbau; bei einigen marinen Arten wird auch die Thylakoidbildung
beeinflußt. Bei Acetabularia
wirkt es als Zeitgeber der endogenen Rhythmik.
© Peter v. Sengbusch - Impressum
 Das
Phytochrom ist ein Chromoprotein, dessen Zustand durch Licht beeinflußt
wird. Es wird vorwiegend bei Dunkelheit gebildet und liegt zunächst
als PR vor (P ist die Abkürzung für Phytochrom, R
steht für red). Nach Bestrahlung mit lambda= 660 nm Licht (hellrot,
red) geht es in PFR über [FR=far red; auf deutsch
könnte man auch schreiben: PHR (hellrot), resp. PDR
(dunkelrot); oder unter Verwendung der Wellenlängen P660,
resp P730]. PFR wird durch lambda = 730 nm
Licht (dunkelrot) in PR rücküberführt. PR
ist die biologisch inaktive, PFR die biologisch aktive Form.
Das
Phytochrom ist ein Chromoprotein, dessen Zustand durch Licht beeinflußt
wird. Es wird vorwiegend bei Dunkelheit gebildet und liegt zunächst
als PR vor (P ist die Abkürzung für Phytochrom, R
steht für red). Nach Bestrahlung mit lambda= 660 nm Licht (hellrot,
red) geht es in PFR über [FR=far red; auf deutsch
könnte man auch schreiben: PHR (hellrot), resp. PDR
(dunkelrot); oder unter Verwendung der Wellenlängen P660,
resp P730]. PFR wird durch lambda = 730 nm
Licht (dunkelrot) in PR rücküberführt. PR
ist die biologisch inaktive, PFR die biologisch aktive Form.



