Botanik online 1996-2004. Die Seiten werden nicht mehr bearbeitet, sie bleiben als historisches Dokument der botanischen Wissenschaft online erhalten!
Die in den beiden vorangegangenen Abschnitten abgeleiteten Enzymkinetiken gelten für einfach gebaute Enzyme. Also für solche, die aus einer Polypeptidkette bestehen, welche ihrerseits wiederum nur ein aktives Zentrum trägt. Die Beteiligung von Koenzymen können wir an dieser Stelle vernachlässigen. Die Inhibitionskinetiken machen deutlich, daß die Molekülkonformation eines Enzyms nicht starr ist, sondern eine begrenzte Flexibilität aufweist. Eine derartige reversible Verformung tritt ein, sobald ein Molekül an das Enzym gebunden wird. Dabei spielt es hier auch keine Rolle, wo es gebunden wird. Moleküle, die eine Formveränderung induzieren, bezeichnet man summarisch als Effektoren. Hierzu können auch Substrate gehören.
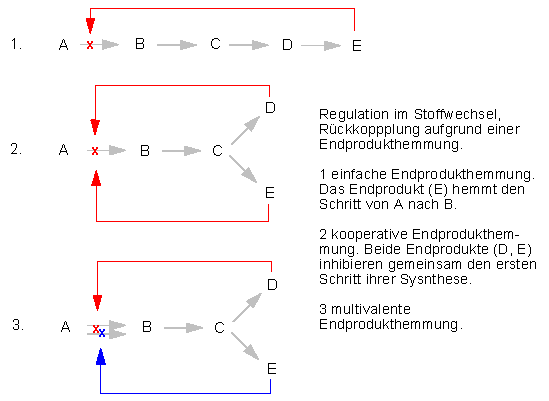
Viele Enzyme, die in verzweigten Biosyntheseketten eine zentrale Schalterposition einnehmen, können durch das Endprodukt des einen oder beider Reaktionswege vorübergehend stillgelegt werden; man spricht dabei von Endprodukthemmung. Sie beruht auf einem Regelkreis, der dafür sorgt, daß die Synthese eines Produkts eingestellt wird, sobald genügend von ihm vorhanden ist.
Eine recht große Gruppe von Enzymen besteht aus mehreren Polypeptidketten. Dabei können sowohl gleichartige als auch zwei oder drei voneinander verschiedene Typen einen Komplex (eine Quartärstruktur) ausbilden. In einem solchen Enzymkomplex funktioniert eine Informationsweitergabe weit besser als zwischen freien Polypeptidketten.
Die Bindung eines Substratmoleküls an eine der (sagen wir einmal vier) Polypeptidketten verformt zunächst deren eigene Struktur. Doch diese Verformung wird dann unmittelbar auf die übrigen drei übertragen, so daß auch deren aktives Zentrum verändert wird.
"Allosterisches Modell" eines tetrameren Proteins. Der Übergang von einem Aktivitätszustand zum anderen (Übergang zwischen zwei alternativen Konformationen) wird durch das Substrat (hier: die kleinen Fische) ausgelöst und erfolgt kooperativ (Nach M. EIGEN und R. WINKLER, 1975)
Dabei stehen zwei Möglichkeiten offen: entweder es gewinnt eine erhöhte Reaktivität (positive Kooperativität) oder eine verminderte (negative Kooperativität, Desensibilisierung). Welche der Alternativen im Einzelfall zutrifft, kann aus der Umsatzkinetik abgelesen werden. Derart geregelte Enzyme aus mehreren Polypeptidketten sind allosterische Enzyme.
Bei einer positiven Kooperativität erhält man eine sigmoide Kurve, was soviel bedeutet, daß das erste Substratmolekül mit schwacher Affinität gebunden wird, während die nachfolgenden von den übrigen, mittlerweile in erhöhte Reaktionsbereitschaft versetzten Polypeptidketten gebunden werden. Der kM-Wert ist hier also keine Konstante, sondern eine Funktion der Substratkonzentration.
Bei einer negativen Kooperativität entsteht ein Signal, die Affinität zum Substrat zu senken.
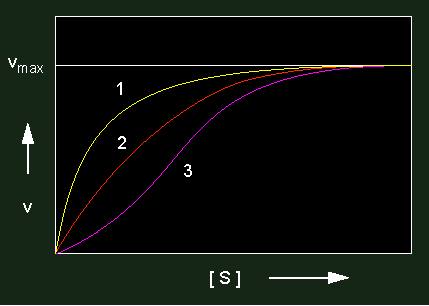
Enzymkinetiken: gelbe Kurve: negative Kooperativität, rote Kurve: nicht kooperativ; violette Kurve: positive Kooperativität. Enzyme mit kooperativen Effekten bestehen stets aus mehreren Untereinheiten (allosterische Proteine).
Die Regulierbarkeit der Enzyme spielt im Stoffwechsel eine nicht mindere Rolle als ihre katalytische Aktivität. Durch sie wird entschieden, welcher von zwei alternativen Stoffwechselwegen in einer gegebenen Situation einzuschlagen ist.
Die Reversibilität der Vorgänge garantiert, daß zu jedem Zeitpunkt eine neue Entscheidung getroffen werden kann und sich die Zelle auf Änderungen im Substrat- und Produktangebot ohne Zeitverzug einstellen kann. Unter dem Gesichtspunkt knapper Rohstoffe und permanenter Energiekrise betrachtet, erkennen wir, daß es sich hierbei um äußerst wirtschaftliche und effizient arbeitende Mechanismen handelt.
Die schnell wirkende reversible Regulierbarkeit beruht auf der Instabilität schwacher Interaktionen, denn alles, was gerade über Bindungen und durch sie ausgelöste Informationsübertragung gesagt wurde, beruht auf ihrem Schließen und Brechen.
Daneben gibt es eine Regulierbarkeit von Enzymen, die auf Veränderungen ihrer Struktur durch Einführen oder Lösen kovalenter Bindungen beruht. Solche Modifikationen sind durchweg irreversibel. Dazu gehören Phosphorylierung und Acetylierung der Proteine sowie die Spaltung der Polypeptidkette, durch die ein Enzym aus einer inaktiven Vorstufe in eine aktive Form überführt wird. Eine Regulation wird aber auch über die Zahl der Enzymmoleküle pro Zelle erreicht.