

Botanik online 1996-2004. Die Seiten werden nicht mehr bearbeitet, sie bleiben als historisches Dokument der botanischen Wissenschaft online erhalten!


Die Wellenzüge des Lichts schwingen normalerweise in alle Richtungen. Durch geeignete Polarisationsfilter kann eine bestimmte Schwingungsebene herausgefiltert werden, so daß linear polarisiertes Licht entsteht. Es kann durch ein zweites Polarisationsfilter total gelöscht werden, wenn man dieses so dreht, daß seine Sperrwirkung senkrecht zu der des ersten steht. Solche, um ihre eigene Achse drehbaren Polarisationsfilter können (zentriert) in den Strahlengang eines Mikroskops eingebaut werden, eines unterhalb des Kondensors (Polarisator), ein zweites oberhalb des Objektivs (Analysator).
Der Einsatz eines solcherart entstandenen Polarisationsmikroskops ist nur dann sinnvoll, wenn Präparate mit Polarisationseigenschaften untersucht werden sollen. Das ist nur dann gegeben, wenn sie aus orientiert zusammengelagerten Einheiten (Molekülen, Atomen) aufgebaut sind (doppelbrechende Kristalle); die Hauptanwendung findet diese Methode daher in der Mineralogie, denn Kristalle sind per definitionem regelmäßig gebaut, und durch Verwendung polarisierten Lichts können die Kristallachsen und die Raumgitter exakt ermittelt werden. In der Biologie ist die Nutzung eingeschränkt, doch kann damit z.B. der Aufbau von Stärkekörnern, die Orientierung von Cellulosefibrillen in der pflanzlichen Zellwand, oder die Lage von stäbchenförmigen Viren (so des Tabakmosa)kvirus) in Zellen analysiert werden.
 Von
der Polarisationsmikroskopie ausgehend, entwickelte der französische
Physiker G. NOMARSKI (Paris) Mitte der fünfziger Jahre die Interferenzkontrastmikroskopie
(auch Differential-Interferenzkontrast; DIC, genannt). Hierfür benötigt
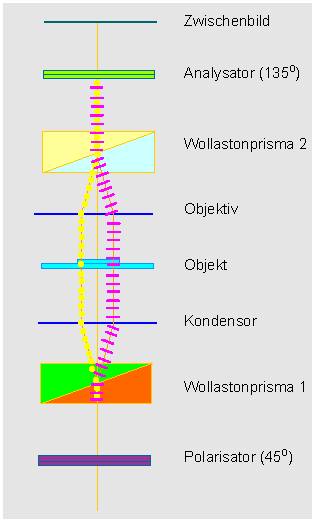
man außer einem Polarisator und einem Analysator zwei Wollaston-Prismen.
Ein Wollaston-Prisma besteht aus zwei verkitteten Kalkspatkeilen. An der
Kittfläche wird ein polarisierter Lichtstrahl in zwei senkrecht aufeinander
stehende Wellenzüge (Teilstrahlen) gespalten. Das erste Wollaston-Prisma
wird in die vordere Brennebene des Kondensors eingesetzt, das zweite in
die hintere Brennweite des Objektivs. Das Objekt wird somit von zwei senkrecht
aufeinander stehenden Wellenzügen durchstrahlt. Diese werden je nach
Dicke oder Brechungseigenschaften des Präparats in ihrer Phase verschoben.
Optimaler Interferenzkontrast entwickelt sich an Kanten im Präparat,
an denen die beiden Teilstrahlen in ihrer Phase unterschiedlich verschoben
werden. Dabei ist es keineswegs gleichgültig, wie das Präparat
orientiert ist. Sinnvollerweise verwendet man daher einen Drehtisch, um
es in allen Orientierungen analysieren zu können.
Von
der Polarisationsmikroskopie ausgehend, entwickelte der französische
Physiker G. NOMARSKI (Paris) Mitte der fünfziger Jahre die Interferenzkontrastmikroskopie
(auch Differential-Interferenzkontrast; DIC, genannt). Hierfür benötigt
man außer einem Polarisator und einem Analysator zwei Wollaston-Prismen.
Ein Wollaston-Prisma besteht aus zwei verkitteten Kalkspatkeilen. An der
Kittfläche wird ein polarisierter Lichtstrahl in zwei senkrecht aufeinander
stehende Wellenzüge (Teilstrahlen) gespalten. Das erste Wollaston-Prisma
wird in die vordere Brennebene des Kondensors eingesetzt, das zweite in
die hintere Brennweite des Objektivs. Das Objekt wird somit von zwei senkrecht
aufeinander stehenden Wellenzügen durchstrahlt. Diese werden je nach
Dicke oder Brechungseigenschaften des Präparats in ihrer Phase verschoben.
Optimaler Interferenzkontrast entwickelt sich an Kanten im Präparat,
an denen die beiden Teilstrahlen in ihrer Phase unterschiedlich verschoben
werden. Dabei ist es keineswegs gleichgültig, wie das Präparat
orientiert ist. Sinnvollerweise verwendet man daher einen Drehtisch, um
es in allen Orientierungen analysieren zu können.
Durch das zweite Wollaston-Prisma werden die beiden Wellenzüge wieder zusammengeführt. Um nunmehr eine Interferenz zu erzielen, müssen die Schwingungsebenen zusammenfallen, was wiederum durch den Analysator bewirkt wird. Ein Interferenzkontrastbild erscheint als plastisches Relief, was jeden Ungeübten zu der Annahme verleiten könnte, man habe es hier mit einer dreidimensionalen Abbildung der Präparatstruktur zu tun. Das ist natürlich nicht der Fall, vielmehr ist es so, daß hier Dichteunterschiede im Präparat in Höhenunterschiede im Bild transformiert werden. Im Gegensatz zur Phasenkontrastmikroskopie können auch relativ dicke Präparate bearbeitet werden.
Neben den Hell-Dunkel-Kontrasten, die man durch Drehung des Polarisators oder durch die Einstellung des zweiten Wollaston-Prismas steigern oder abschwächen kann, lassen sich (durch Einsatz eines lambda / 4-Plättchens) auch verschiedene Farbkontraste erzielen.

Das Wollastonprisma, ein Strahlenteiler. Punkte und Linien geben die Polarisationsrichtung der jeweiligen Strahlen (Teilstrahlen) an (Nach Werkphoto CARL ZEISS)
Strahlengang in einem Interferenzkontrastmikroskop