
Botanik online 1996-2004. Die Seiten werden nicht mehr bearbeitet, sie bleiben als historisches Dokument der botanischen Wissenschaft online erhalten!
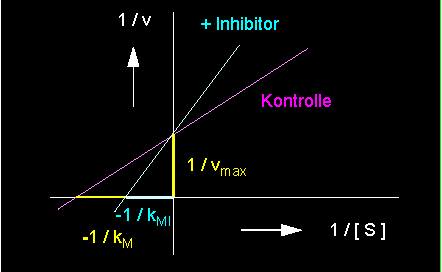
Es gibt eine Anzahl von Molekülen (Inhibitoren, I), die aufgrund ihrer Struktur einem Substratmolekül ähneln. Sie werden daher gleichermaßen am aktiven Zentrum gebunden, werden jedoch meist wegen ihrer chemischen Eigenarten nicht umgesetzt. Sie kompetieren (konkurrieren) um die Bindungsstelle mit den eigentlichen Substratmolekülen. Oftmals ist ihre Affinität zum Enzym sogar weit höher als die des Substrats, so daß jenem keine Chance mehr gegeben ist, mit dem Enzym zu reagieren. Die Enzymmoleküle werden durch die Inhibitorbindung damit weitgehend inaktiviert. Diese kompetitive Hemmung läßt sich aus der folgenden Reaktionskinetik ablesen.
Aus ihr ist zu ersehen, daß der kM-Wert zugenommen hat, denn es entsteht ja im wesentlichen der EI-Komplex anstelle des ES-Komplexes. Die Wirkung des Inhibitors hängt damit direkt von seiner Konzentration und dem Verhältnis [Substrat] / [Inhibitor] ab.


linkes Bild: Reduktion der Umsatzgeschwindigkeit einer enzymkatalysierten Reaktion durch einen kompetitiven Hemmstoff (Inhibitor) (kompetitive Hemmung) (blaue Kurve) - rot: Kontrolle = nicht inhibiert, rechtes Bild: Kompetitive Hemmung in der Darstellung nach Lineweaver und Burk.
Ein zweiter Typ von Inhibitor führt zu der nichtkompetitiven Hemmung. Er wird nicht am aktiven Zentrum, sondern an einer beliebigen anderen Stelle der Enzymoberfläche gebunden. Als Folge davon wird die Gestalt des Enzyms und damit auch der Substratbindungsstelle verformt, so daß das Substratmolekül nunmehr weniger gut paßt. Es wird deshalb auch weit weniger umgesetzt. Der kM-Wert bleibt unverändert, die Substratkonzentration hat auf die Inhibitorwirkung keinen Einfluß.
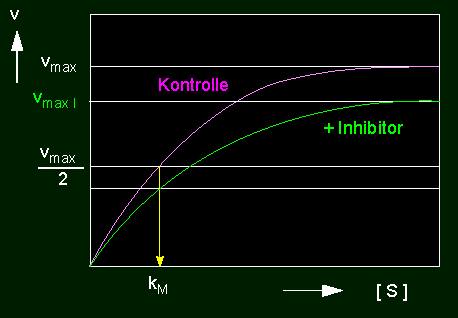
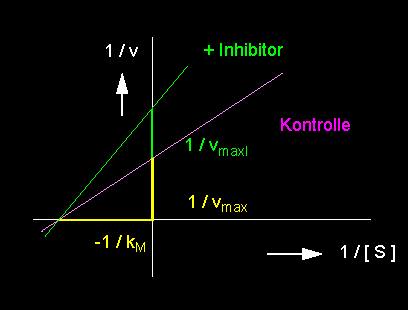
linkes Bild: Reduktion der Umsatzrate einer enzymkatalysierten Reaktion durch einen nichtkompetitiven Hemmstoff (Inhibitor). Nichtkompetitive Hemmung: vmax wird reduziert, der kM-Wert bleibt unverändert. rechtes Bild: Nichtkompetitive Hemmung in der Darstellung nach Lineweaver und Burk.
Es gibt Inhibitoren, deren Wirkung reversibel ist, d.h., nach dem Auswaschen ist der alte Zustand wiederhergestellt. Es gibt aber auch solche, deren Wirkung nicht wiedergutzumachen ist, da sie das Enzym in seiner Struktur irreversibel beeinträchtigten (denaturieren).
Eine Inaktivierung kann einerseits durch Moleküle (chemisch), andererseits aber auch durch physikalische Faktoren (Temperatur, kurzwellige Strahlung usw.) erreicht werden. Darin begründet liegt der Tatbestand, daß jedes Enzym ein Temperaturoptimum hat, denn Umsatzrate und Enzyminaktivierung sind einander entgegengesetzte temperaturabhängige Prozesse.
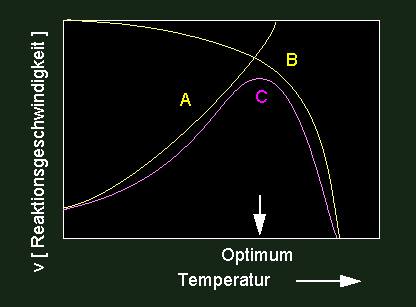
Eine Optimumskurve (violett) ist das Ergebnis fördernder und hemmender Einflüsse. Ein Temperaturanstieg führt zunächst zu einer Steigerung von Enzymaktivitäten; bei stärker steigender Temperatur beginnen Denaturierungserscheinungen (thermische Denaturierung) zu überwiegen. Optimumskurven sind nur selten symmetrisch gebaut. Ein beschleunigter Abfall von Aktivitäten ist üblich.
Läßt man eine enzymatisch katalysierte Reaktion bei unterschiedlichen Temperaturen ablaufen, erhält man eine Kurvenschar aus Kinetiken unterschiedlicher Form.
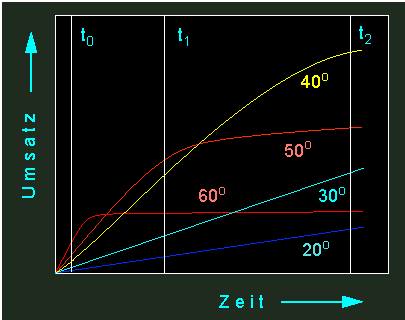
Unterschiedliche Umsatzraten eines Enzyms bei verschiedenen Temperaturen. Mit steigender Temperatur steigt die Umsatzrate, gleichzeitig aber auch die thermische Inaktivierungsrate des Enzyms. Es gibt daher einen optimalen Temperaturbereich für eine Enzymaktivität (der Wert ist für jedes Enzym spezifisch). Gelbe Kurve: Reaktionen bei 40 ºC, orange: 50 ºC, hellblau: 30 ºC, rot: 60 ºC, dunkelblau: 20 ºC.
Aus der entsprechenden Graphik ist abzulesen, daß die Durchbiegung der Zeitumsatzkurve um so deutlicher ausfällt, je höher die Temperatur ist. Das heißt, zu Beginn der Reaktion sind alle in Lösung befindlichen Enzymmoleküle noch voll aktiv und zeichnen sich durch gesteigerte Umsatzraten (im Vergleich zu Werten, die bei niederer Temperatur gemessen wurden) aus. Bei fortschreitender Zeit fallen mehr und mehr Moleküle durch Thermodenaturierung aus, was bedeutet, daß das Temperaturoptimum um so niedriger liegt, je länger die Reaktionsdauer ist. Bei einer recht hohen Temperatur (wie z.B. schon bei 37 ºC) kann ein Enzym in kurzer Zeit zwar viel leisten, muß jedoch ständig durch neu synthetisierte Enzymmoleküle ersetzt werden, um den Ansprüchen der Zelle (z.B. in einem tierischen Warmblüter oder in einer Pflanzenzelle, die direkter intensiver Sonnenstrahlung ausgesetzt ist) gerecht zu werden. Wie aus der folgenden Abbildung hervorgeht, können aus Reaktionskinetiken eine ganze Anzahl von Parametern erschlossen werden, die für das Verständnis von Umsatzraten nützlich sind.
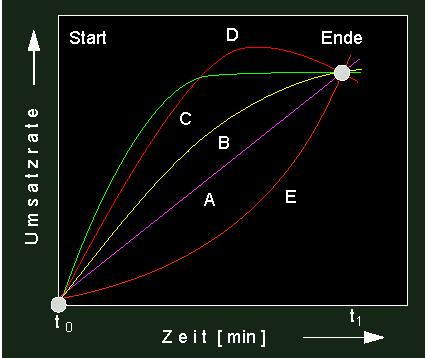
Unterschiedliche Reaktionskinetiken. Aus der Form der Kinetik lassen sich folgende Schlüsse ziehen: VioletteKurve: linearer Verlauf = konstante Reaktionsgeschwindigkeit, gelbe und grüne Kurve: fortlaufende Reaktionsverzögerung: Dem Reaktionsablauf läuft ein Inaktivierungsprozeß entgegen, oder die Reaktion verlangsamt sich aufgrund einer Substraterschöpfung. rote Kurve: Störung der Reaktion durch entgegengesetzt verlaufende Umsetzung. orange Kurve: autokatalytischer Kurvenverlauf (positive Rückkopplung, s. folgenden Abschnitt).