Botanik online 1996-2004. Die Seiten werden nicht mehr bearbeitet, sie bleiben als historisches Dokument der botanischen Wissenschaft online erhalten!
Der wichtigste Bindungstyp in organischen Molekülen ist die kovalente Bindung. Sie ist durch ein gemeinsames Elektronenpaar zwischen zwei in einem Molekül benachbarten Atomen gekennzeichnet. Abhängig von den dabei beteiligten Partnern, können Einfach-, Doppel- und Dreifachbindungen ausgebildet werden (H-H, O=O, N=N).
Das delta G einer kovalenten Bindung liegt größenordnungsmäßig bei -50 bis -100 kcal/mol (ca. -210 bis -420 kJ/mol), d.h., in ihr ist ein ansehnlicher Energiebetrag gespeichert. Moleküle befinden sich in einem sogenannten energiearmen Zustand, denn die Energie wird zur Aufrechterhaltung der Bindungen festgelegt. In Zellen sind am Lösen und Neuknüpfen kovalenter Bindungen Enzyme beteiligt.
Neben der eben genannten starken (chemischen) kovalenten Bindung sind die Moleküle zur Ausbildung einer Anzahl verschiedener Nebenvalenzen oder schwachen Interaktionen (Wechselwirkungen) befähigt. Oft wird auch der Begriff schwache Bindungen genannt. Das mag zu Mißverständnissen führen, weil man bei einem delta G von -1 bis -7 kcal/mol (ca. -4 bis -30 kJ/mol) wohl kaum von einer Bindung reden darf. Diese Beträge liegen nämlich nur knapp über denen der thermischen Molekularbewegung (-0,7 kcal/mol; ca. -3 kJ/mol). Unter physiologischen Bedingungen werden Nebenvalenzen kontinuierlich geschlossen und wieder gebrochen, wobei die Halbwertszeit meist nur den Bruchteil einer Sekunde ausmacht. Enzyme sind an diesen Prozessen in der Regel nicht beteiligt.
Unter allen Reaktionsbedingungen besteht die Tendenz, die jeweils stärkstmögliche Wechselwirkung einzugehen. Nebenvalenzen sind besonders deshalb so wichtig, weil sie sich additiv verhalten und in der Summe außerordentlich stabile Molekülkonformationen bedingen. So werden die Sekundär- Tertiär- und Quartärstruktur von Proteinen, die Doppelhelix der DNS, die Membranstrukturen sowie komplexe intrazelluläre Einheiten, wie etwa die Ribosomen, durch solche Bindungen zusammengehalten. Eine entscheidende Rolle spielt dabei die Gestalt der beteiligten Reaktionspartner. Je komplementärer die Strukturen zueinander sind, je besser sie also zueinander passen, desto mehr schwache Wechselwirkungen können eingegangen werden, und um so stabiler ist die sich bildende Konformation (oder das sich bildende Aggregat).
Ionische Interaktionen (Bindungen). Dieser Interaktionstyp trägt vielleicht am ehesten zu Recht die Bezeichnung Bindung. Das delta G liegt in der Größenordnung von -5 bis -7 kcal/mol (ca. -20 bis -30 kJ/mol). Es handelt sich hierbei um elektrostatische Kräfte, die zwischen Ionen mit entgegengesetzten Ladungen (Kat- und Anionen, ionisierte Basen und dissoziierte Säuren) auftreten. In nichtwäßrigem Milieu können sie beträchtliche Stärke erreichen. Ihretwegen hat z.B. ein Na+Cl- -Kristall den doch sehr hohen Schmelzpunkt von 801 oC.
Wasserstoffbrücken: Wasser als elektrostatisches Lösungsmittel. In einem Wassermolekül sind die Elektronen ungleichmäßig verteilt, da sie vom Sauerstoff stärker als vom Wasserstoff angezogen werden. Elektronegative Atome haben daher die Tendenz zu einer Polarität und verleihen dem Molekül ein gerichtetes Dipolmoment.

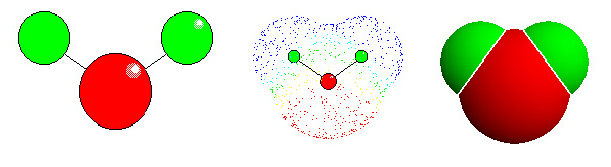
Wasser: links "ball-and stick"-Modell. Die Lage der Atome wird deutlich (rot: Sauerstoff, grün: Wassrstoff - in den meisten anderen Abbildungen in Botanik online wurde die Farbe türkis für Wasserstoff gewählt). Mitte: Elektronendichteverteilung. Die Elektronenwolken entsprechen den van der Waals Radien der einzelnen Atome. Für Wasserstoff beträgt der Radius 1,2 Å, für Sauerstoff 1,4 Å. Die Länge der kovalenten Bindung zwischen O und H beträgt 0,95 Å. Die ungleiche Ladungsverteilung bedingt ein Dipolmoment. Rechts: Kalottenmodell.

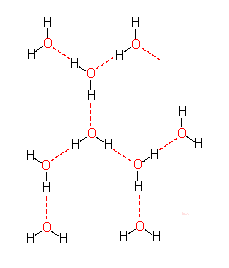
Dipoleigenschaften eines Wassermoleküls. Ausbildung von Hydrathüllen und Orientierung der Wassermoleküle in einer Hydrathülle in Abhängigkeit von der Ladungsverteilung im hydrierten Molekül. - Wasserstoffbrücken zwischen Wassermolekülen (Bild unten)
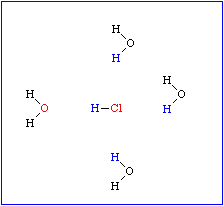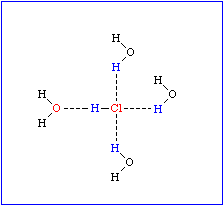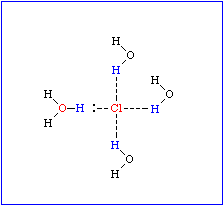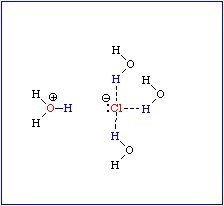
|
Das führt zu einem partiellen Ionencharakter (ungleiche Ladungsverteilung im Molekül), wodurch die negative Seite des Moleküls eine Affinität zur positiven Seite in benachbarten Molekülen gewinnt. Diese Art der Interaktion wird Wasserstoffbrücke genannt. Sie ist keineswegs auf Wasser beschränkt, sondern wird überall dort ausgebildet, wo sich ein kleines elektronegatives Atom (z.B. Sauerstoff, Stickstoff, Fluor) und ein Wasserstoffatom, das kovalent an ein anderes elektronegatives Atom gebunden ist, nahe kommen.
Beispiele:
-O-H . . . . O=
=N-H . . . . O=C-
-N+-H . . . . O=
Bei Makromolekülen können sowohl inter- als auch intramolekulare Wasserstoffbrücken ausgebildet werden. Sie sind am stärksten, wenn die beteiligten Atome linear angeordnet sind. Sobald zwischen den beteiligten Gruppen Winkel liegen, nimmt die Stärke der Interaktionen drastisch ab. Die Länge einer Wasserstoffbrücke liegt je nach Typ der daran beteiligten Gruppen zwischen 2,7 und 3,1 Å.
Wasserstoffbrücken sind die Ursache des hohen Schmelz- und Siedepunkts des Wassers. Die Form des Moleküls und die Struktur der Nebenvalenzen bedingen die Kristallform von Eis, und selbst in der flüssigen Phase liegt noch ein hoher Ordnungsgrad vor, wobei die Wassermoleküle eine Micellenstruktur annehmen.
Der polare Charakter des Wassers spiegelt sich in einer hohen Dielektrizitätskonstante (80 bei Zimmertemperatur) wider. Das bedeutet, daß sich zwei elektrische Ladungen mit entgegengesetztem Vorzeichen im Wasser mit nur 1/80 der Kraft anziehen, die sie in Luft (oder im Vakuum) aufeinander ausüben, und daraus folgt, daß sich Ionen, z.B. die eines Na+ Cl- -Kristalls, in Wasser erheblich leichter aus der Kristallstruktur lösen als in Luft, weil die Kraft, die das Ion zur Kristalloberfläche zurückzieht, in Wasser nur 1/80 so stark wie in Luft ist. Es genügt somit (bei Zimmertemperatur) die thermisch bedingte Molekularbewegung, um die relativ schwachen Anziehungskräfte der Ionen im Kristall (ionische Bindung) zu überwinden und sie ins wäßrige Medium dissoziieren zu lassen. Wassermoleküle haben eine ausgeprägte Tendenz zu einer Hydrathüllenbildung. Damit schirmen sie ionische Ladungen weitgehend ab und neutralisieren sie partiell; sie orientieren sich im elektrostatischen Feld und werden damit immobilisiert
Durch die in geringem Ausmaß auftretende Eigendissoziation entstehen Wasserstoffionen (Protonen): H+, bzw. H3O+ und Hydroxylionen -OH-, bzw. H3O2-, die ihrerseits mit Ionen gelöster Stoffe in Wechselwirkung stehen, d.h. ionische Bindungen eingehen.
Van der Waals'sche Interaktionen. Hierbei handelt es sich um unspezifische Anziehungen zwischen zwei Atomen, die nahe beieinander liegen. Die Wechselwirkungen sind von den Abständen der in Beziehung stehenden Atome (oder Atomgruppen bzw. Moleküle) abhängig. Bei zu geringen Abständen dominieren abstoßende Kräfte (Überlappung von Elektronenschalen). Die Energie in den van der Waals'schen Interaktionen ist nur geringfügig höher als die Energie der Molekularbewegung: -0,7 bis -1kcal/mol (ca. -3 bis -4 kJ/mol). Daraus ist zu schließen, daß die van der Waals'schen Interaktionen unter physiologischen Bedingungen nur dann eine Rolle spielen, wenn möglichst viele Atome in einem Molekül an solchen Interaktionen beteiligt sind. Sie sind am stärksten, wenn, wie schon eingangs dargelegt, die beteiligten molekularen Strukturen einander komplementär sind (komplementäre Moleküloberflächen gufweisen). Van der Waals'sche Interaktionen verhalten sich additiv und spielen deshalb bei Makromolekülen eine weit größere Rolle als bei den kleinen. Die Bindung eines Substrats an ein Enzym wird zum großen Teil durch van der Waals'sche Interaktionen stabilisiert. Je höher sie ist, desto höher ist die Affinität eines Enzyms zum Substrat. Eine Energie von 2-3 kcal/mol (ca. 8-12 kJ/mol) ist in der Zelle normalerweise ausreichend, um eine genügende Selektivität zu garantieren. Die Energie einer Wechselwirkung zwischen einem Enzym und dem Substrat darf aber auch nicht zu hoch sein, denn eine hohe Umsatzzahl am Enzym ist nur durch schnelles Binden und Wiederlösen des Substrats (respektive des gebildeten Produkts) vom Enzym gewährleistet.