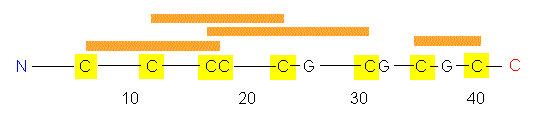Botanik online 1996-2004. Die Seiten werden nicht mehr bearbeitet, sie bleiben als historisches Dokument der botanischen Wissenschaft online erhalten!
Lektine
Lektine sind zuckerbindende Proteine mit der Eigenschaft, Zellen
zu agglutinieren und/oder Glykokonjugate (= Moleküle mit
einem Kohlenhydratanteil (Polysaccharide, Glykoprotein, Glykolipide
u.a.) zu präzipitieren.
Da sie ursprünglich nur aus Pflanzenextrakten isoliert worden
sind und zur Agglutination von Blutzellen (Erythrozyten) eingesetzt
wurden, sprach man zunächst von Phytohaemagglutininen. Später
stellte es sich heraus, daß sie auch aus tierischen Organen
(vornehmlich der Invertebraten) zu gewinnen sind und daß
keineswegs alle an Erythrozyten binden. W. C. BOYD und E. SLAPEIGH
führten daher 1954 den Begriff Lektin (lat: legere = auswählen)
ein. Lektine besitzen mindestens zwei Zuckerbindungsstellen, sonst
wäre ihr Agglutinations-/Präzipitationsvermögen
nicht erklärbar. In der Tat bestehen die meisten von ihnen
aus zwei, vier oder mehr meist gleichartigen Untereinheiten. Ihre
Spezifität wird durch jenes Mono- oder Oligosaccharid definiert,
welches das Agglutinationsvermögen kompetitiv inhibiert.
Die Affinität eines Lektins zu Zellen oder Makromolekülen
(Liganden) liegt um Größenordnungen über der zu
einzelnen Zuckern. Daraus wurde geschlossen, daß es bei
der Bindung der Liganden nicht nur auf die Kohlenhydratanteile
ankommt, sondern daß zusätzliche, unspezifische Protein-Protein-
Wechselwirkungen (schwache Bindungen) den Komplex stabilisieren.
Man kennt beispielsweise eine Reihe von Lektinen
(so z.B. RCA, PNA, SBA) mit einer Affinität zu beta-D-Galactosylresten,
doch findet man deutliche Unterschiede in ihrem Bindungsvermögen
zu bestimmten Zellen oder Glykoproteinen. Einen großen Einfluß
übt die sterische Lage der Kohlenhydrate an der Molekül-
oder Zelloberfläche aus; sie müssen für das Lektin
zugänglich sein. Wegen der strukturellen Komplexität
der Liganden werden die lektinbindenden Moleküle üblicherweise
als Lektinrezeptoren bezeichnet. Trotz gewisser Unsicherheiten
bezüglich ihrer chemischen Charakterisierung werden Lektine
in den letzten Jahrzehnten in steigendem Umfang in der medizinischen
Grundlagenforschung eingesetzt. Sie eignen sich, um bestimmte
Zelltypen oder Zellfragmente (z.B. Membrantypen) zu charakterisieren,
Zellen in verschiedenen Entwicklungsstadien zu erkennen, normale
von Tumorzellen zu unterscheiden, die verschiedenen Phasen des
Zellzyklus zu markieren und verschiedene Zelltypen affinitätschromatographisch
voneinander zu trennen.
Durch Konjugation an Fluoreszenmarker erhielt man geeignete Sonden
zur Lokalisation von Glykokonjugaten
in Zellen oder an Zelloberflächen. Eine entsprechende Markierung
der Lektine mit elektronendichten Substanzen (Ferredoxin, kolloidalem
Gold u.a.) machte sie zu geeigneten Hilfsmitteln in der Elektronenmikroskopie.
Bisher gibt es allerdings noch nicht sehr viele derartige Untersuchungen
an Pflanzenzellen.
Obwohl einige der beschriebenen Eigenschaften auch auf Antikörper
zutreffen, haben sie und die Lektine nicht viel gemeinsam:
Das in Vicia faba vorkommende Favin weist einige überraschende
Übereinstimmungen mit dem ConA auf. Es enthält zwei
ungleich lange Polypeptidketten (alpha und beta).
Die alpha-Kette ist dem Abschnitt 70-119 der ConA-Polypeptidkette
homolog, die beta-Kette den Abschnitten 120-237, gefolgt
von 1-69. Wir haben es also hier mit einer "zyklischen Permutation"
von Polypeptidabschnitten zu tun. Solange keine weiteren Daten
vorliegen, läßt sich jedoch nicht entscheiden, ob die
ConA-Sequenz die ältere ist und Favin durch Herausnahme des
Mittelstücks und einen Platzwechsel der beiden Außenstücke
entstand oder ob das ConA durch Fusion der zwei Polypeptidketten
des Favins gebildet wurde.
Die Polypeptidkette des WGA enthält 164 Aminosäurereste,
darunter zahlreiche disulfidbrückenbildende Cysteinreste.
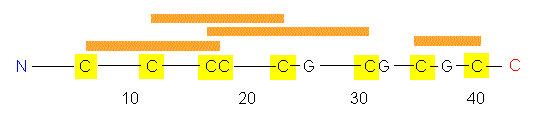
Die Aminosäurekette faltet sich zu einer
Tertiärstruktur,
die aus vier Domänen (A,B,C,D) besteht. Zwischen A, B und
C, D ist, wie bei vielen Enzymen, eine Spalte vorhanden. Die Zuckerbindungsstellen
liegen aber nicht dort, sondern an der Molekülaußenseite.
Ist das vielleicht der Grund dafür, daß WGA nicht als
Enzym wirkt? An der Außenseite herrschen nicht die "besonderen
Bedingungen", durch die sich ein aktives Zentrum eines Enzyms
auszeichnet.
Der Vergleich der Tertiärstrukturen von ConA und WGA macht
deutlich, daß keine Gemeinsamkeiten vorhanden sind. Es ist
eher so, daß die Domänen A, B, C und D des WGA sich
untereinander sehr ähnlich sind. Man muß daher annehmen,
daß das Gen für WGA durch zwei aufeinanderfolgende
Duplikationen eines Urgens entstanden ist.
Aufgrund vorhandener serologischer Kreuzreaktionen ließ
sich zeigen, daß verschiedene Gramineen Lektine enthalten,
die mit dem WGA serologisch und damit wohl auch strukturell verwandt
sind. Offenbar liegt hier eine Proteinfamilie vor. Die Lektine
der Leguminosen sind durchweg Metalloproteine. Ob das auch auf
eine phylogenetische Verwandtschaft hinweist, bleibt offen.
Welche Bedeutung haben die Lektine für die Pflanze? Es ist
hinlänglich bekannt, daß Zuckerreste an Zelloberflächen
vorhanden sind und daß einzelne Zelltypen, respektive deren
Entwicklungsstadien, sich durch ihr Kohlenhydratmuster voneinander
unterscheiden.
Es war daher naheliegend zu testen, ob Lektine an Erkennungsprozessen
mitwirken. Die Beteiligung bestimmter Lektine ließ sich
für folgende Fälle belegen:
 |
Zell-Zell-Erkennung, z.B. Paarungstypen bei Algen (Chlamydomonas) u.a.); |
 |
Pollen-Stigma-Interaktion. |
 |
Erkennung von Symbiosepartnern, z.B. bei der Bindung
von Rhizobium-Arten an Wurzelhaaren der spezifischen Wirtspflanzenarten
(hier: Leguminosen).
|
 |
Erkennung von parasitären Pilzen und nachfolgende Induktion
von Abwehrmechanismen der Pflanzen.
|
Viele der Lektine sind intrazellulär lokalisiert, zum Teil
kommen sie dort in beträchtlichen Mengen vor, doch welche
Bedeutung ihnen zukommt, ist weitgehend unbekannt. Sie reagieren
mit Speicherproteinen, wobei die Affinität zum arteigenen
Speicherprotein weit höher ist als zu einem artfremden. Hieraus
wurde geschlossen (S.-K. M. BASHA und R. M. ROBERTS, 1981), daß
sie die Proteine komplexieren und sie so in eine kompakte unlösliche
Form überführen, in der sie in der Zelle besser lagerfähig
sind als in gelöstem Zustand.
Viele Lektine sind toxisch und bieten der Pflanze möglicherweise
einen Schutz vor Freßfeinden. Zum Beispiel wirkt das Lektin
der Gartenbohne (Phaseolus vulgaris) auf den Käfer
Callosobruchus maculatus letal. Das Ricinus communis
Agglutinin (RCA) enthält eine für alle Tiere und den
Menschen hochgiftige Komponente, das Ricin. Im Experiment mit
tierischen Zellen wurde gezeigt, daß einige Lektine in geringen
Konzentrationen zellteilungsfördernd wirken (daher auch die
Bezeichnung Mitogene). Inwieweit das für die Pflanzen von
Bedeutung ist, bleibt zu klären.
© Peter v. Sengbusch - Impressum